CRISPR-Cas系统是原核生物的一种适应性免疫系统,能够通过RNA引导蛋白质靶向降解外源DNA,抵御病毒和外来遗传物质的入侵。CRISPR-Cas系统分为两大类:Class1和Class2。Class1系统包含多个效应蛋白,而Class2系统则依赖单一效应蛋白(如Cas9、Cas12和Cas13),后者已被广泛应用于基因组编辑技术中。Class1中典型的I-E型CRISPR-Cas系统依赖于Cas3核酸酶进行DNA降解,但近年来科学家发现了一种新型的I-E型变体系统,该系统缺乏Cas3,而是通过HNH核酸酶结构域来实现精确的DNA切割。
近期,中国科学院物理研究所/北京凝聚态物理国家研究中心软物质与生物物理实验室SM10组朱洪涛特聘研究员与天津医科大学基础医学院张恒教授组成联合研究团队,通过冷冻电镜技术揭示了Cas5-HNH/Cascade复合物在结合DNA前后的结构变化,为理解这一新型CRISPR-Cas系统的组装和激活机制提供了重要线索。
本研究聚焦于一种由Cas5蛋白和HNH结构域组成的新型I-E型CRISPR-Cas系统,该系统显著不同于传统的Cas3依赖系统,展现出更高的切割精确性。研究团队利用先进的冷冻电子显微镜技术,在接近原子分辨率下解析了该新型系统在结合DNA前后的三维结构(图1)。结果显示,Cas5-HNH/Cascade复合物在结合DNA后,其构象变得更加紧凑,各亚基向核酸酶中心靠拢,从而激活了HNH结构域的切割活性。研究同时揭示了HNH结构域与相邻亚基之间的广泛相互作用,这些相互作用对复合物的功能至关重要。研究团队通过生化实验进一步验证了HNH结构域的关键氨基酸残基对其核酸酶活性的影响。这些发现为理解HNH的调控机制提供了新的视角。此外,研究还发现,某些二价金属离子(如锌、钴和镍)能够通过破坏Cascade复合物的稳定性来抑制其酶活性。这一发现为CRISPR-Cas系统提供了潜在的调控策略。该研究的另一个重要发现是,Cas5-HNH/Cascade复合物在切割双链DNA时,首先切割目标链,随后切割非目标链。这一独特的切割机制进一步丰富了科学家对CRISPR-Cas系统多样性的理解。这项研究不仅揭示了Cas5-HNH/Cascade复合物的结构和功能机制,还为未来开发基于CRISPR的新型基因编辑工具提供了重要的理论基础,通过理解这些复杂的分子机制,科学家有望设计出更加精确和高效的基因编辑系统。
本工作受到了在国家自然科学基金项目和中国科学院资助。成果以“Structural basis for RNA-guided DNA degradation by Cas5-HNH/Cascade complex”为题发表在Nature Communications。
文章链接:https://www.nature.com/articles/s41467-024-55716-7#Ack1.
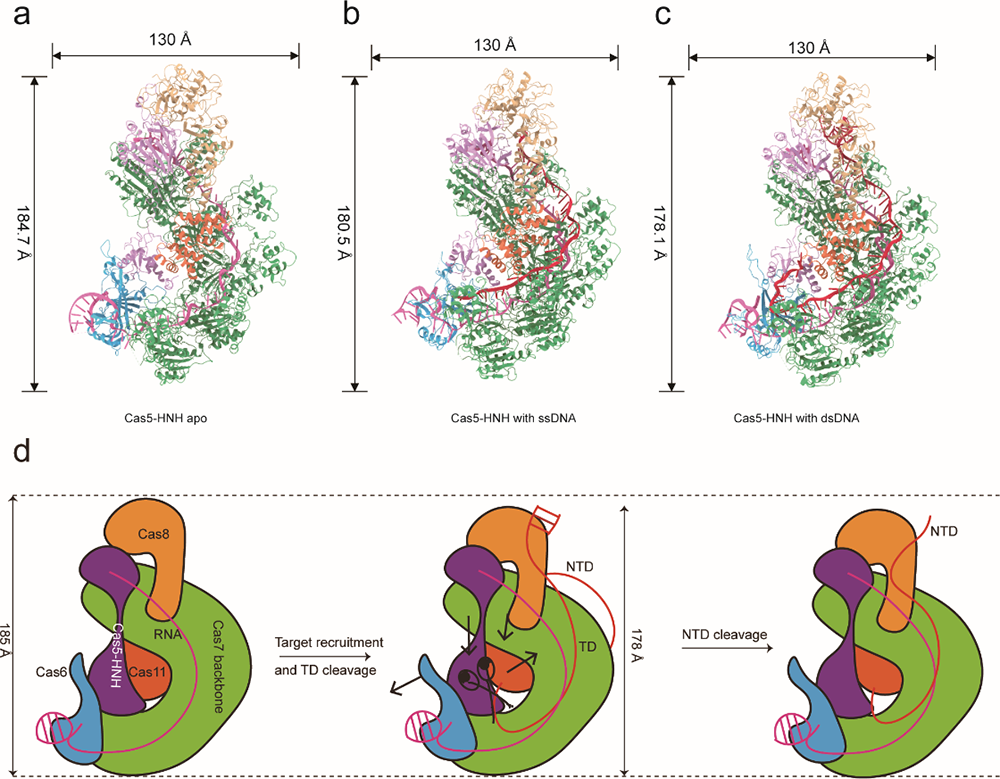
图1 Cas5-HNH/Cascade系统切割靶标DNA的分子模型

